Гелий является одним из инертных газов. Это одноатомный газ, не взаимодействующий с металлами. Гелий не является токсичным. В нормальных условиях кипение гелия невозможно, переход в твердую фазу также невозможен. Именно этим объясняется интерес к гелию как одному из возможных теплоносителей для высокотемпературных газовых реакторов. Природный гелий почти полностью состоит из 4He (99,999863±6·10 -6 %). Примесь 3Не весьма незначительна. Ниже описаны теплофизические характеристики гелия в диапазоне температур от 300 до 2500 K и при давлении от 0,1 дo 6 MПa. При этом систематизировались и анализировались данные из работ .
Если для открытия аргона Рамсей работал с Рэлеем в течение двух лет, идентификация гелия делалась через два дня. Кейд обнаруживает присутствие гелия в природном газе Канзаса. Рамсей пришел к выводу, что после гелия с атомным весом 4 и аргоном с атомной силой 40 должно быть несколько человек, которые также описывали его свойства и атомный вес 20.
За это время он обнаружил, что младший химик Моррис Уильям Траверс, который в возрасте 21 года только что закончил его кандидатскую диссертацию, пришел в качестве помощника Рэмси. Эти два человека расправляют свои исследования минералов, минеральных вод и метеоритов, но они не дают никаких результатов.
Приведенная погрешность соответствует 95% квантилю нормального распределения.
В диапазоне температур 300 ÷ 2500 К и давлений 0,1 ÷ 6,0 МПа (в состояниях, далеких от критического, при ρ/ρ cr 60) гелий находится в состоянии разреженного газа. В этой области термодинамические свойства гелия описываются в первом приближении уравнением состояния идеального газа pv = RT. Отличие состояния гелия от состояния идеального газа должно быть учтено за счет вириальных коэффициентов. В частности, при вычислении объема и коэффициента вязкости ν(Т) следует вводить поправку в виде второго вириального коэффициента, моделирующего парные взаимодействия атомов. Вычисление плотности требует учета эффектов второго порядка малости (тройные столкновения).
Линде, в Германии и Великобритании сделала для этой цели все более сложные машины. Хэмпсон посылает Рамсей один из первых образцов жидкого воздуха; 100 сантиметров. Рамсей и Траверс устраняют почти весь азот и кислород путем фракционной дистилляции, а оставшиеся кубические сантиметры остаются предметом спектрального анализа, в котором они идентифицируют аргон. Но появился новый спектр, состоящий из двух линий: одного желтого и одного зеленого.
Непосредственно перед завершением счастливого Рэмси, чьи спектроскопа не кажется большой чувствительность, посланным образец Крукса подтвердить свое существование криптона и Крукс отвечает:. Криптон гелий, Рэмсите еще не достиг криптона. Определение плотности, а затем атомной массы Криптона было найдено. В таблице Менделеева он должен был быть помещен между бромом и рубидием. Но элемент между Неем и Ар еще не был обнаружен; его нужно искать в более летучей фракции жидкого остатка воздуха.
Обобщение теплофизических характеристик газообразного гелия проводилось двумя способами. При высоких температурах использовался в соответствии с работой полуэмпирический метод подобия свойств в рамках парных взаимодействий одновременно для всех пяти инертных газов. В другом случае, как описано в работе обобщение разнородных свойств гелия проведено на основе параметрического потенциала взаимодействия U(ρ). При совместной обработке учитывались экспериментальные данные о дифференциальном и интегральном сечениях рассеянных атомных пучков He - He, а также теплофизические данные, при высоких температурах о втором вириальном коэффициенте до уровня 1473 К, о коэффициенте вязкости до уровней 1600 К и 2150 К и о коэффициенте теплопроводности до - 2400 К и 2100 К. На основе восстановленного потенциала, представленного в работе рассчитаны таблицы справочных величин для коэффициентов β (Т) и α (Т) гелия в диапазоне температур от 5 до 5000 К.
Таким образом, Рамсей и Траверс вводят аргон в жидкий воздух и после сжижения затвердевают, а затем отгоняют его с особой осторожностью при пониженном давлении. Собирая первые порции, полученные в результате испарения аргона, они получают часть, которая анализируется на спектроскопе, создавая новый спектр с ярко-красными линиями. С плотностью 10 и атомной массой 20 неоном является именно тот элемент, который должен быть помещен между Не и Ар.
Таким образом, у них есть возможность сжигать большее количество воздуха. Таким образом, Рэмси и Траверс обнаружили пятый инертный газ, перерабатывающий 77, 5 млн. Литров атмосферного воздуха, получая всего 300 сантиметров ксенонов. Все эти элементы представляют собой семейство элементов, характеризующихся: моноатомными, нулевантными молекулами, помещенными в таблицу Менделеева между щелочными и галогенными металлами.
Эти таблицы приняты Росстандартом и получили категорию рекомендованных данных в Государственной службе стандартных справочных данных (ГСССД). Подтверждением достоверности справочных величин являются результаты независимых обобщений, приведенные в работах, которые соответствуют основным экспериментальным данным, полученным в пределе оцененных погрешностей последних.
Атмосфера - это газообразная оболочка планеты, протянутая на сотни километров над поверхностью. Он граничит с литосферой и гидрофорезом, находясь в верхней части открытого космоса. Большинство живых процессов происходит в нижней части процесса. Для существования жизни атмосфера играет несколько ролей: она дает нам воздух, которым мы дышим, его газы сохраняют тепло, а озоновый слой - защита от вредного излучения.
С физической точки зрения атмосфера является текучей средой, а среди основных элементов окружающей среды она наиболее динамична, страдает значительные изменения в короткие интервалы. Энергия этого покрытия неразрывно связана с положением нашей планеты против Солнца.
В разделе приводятся данные для расчета теплофизических характеристик газообразного гелия в указанном диапазоне параметров: источники, расчетные выражения, размерности величин, оценки погрешностей, а также комментарии.
При расчете теплофизических свойств гелия используются соотношения: температура Т = 300÷2500 К, давление Р = 0,1÷6 МПа.
С физической точки зрения атмосфера состоит из смеси газов, несущих в суспензии твердые, жидкие или газообразные частицы земного или космического происхождения, естественные или антропные. Твердые, газообразные или взвешенные частицы в воздухе представляют собой физическую сборку, называемую атмосферным аэрозолем. Основными ингредиентами являются азот и кислород. Остальные 3 процента состоят из аргона, двуокиси углерода, следов нескольких газов и водяного пара. Приблизительно на 90 км над поверхностью Земли различные газы начинают разделяться в зависимости от их плотности.
Фундаментальные константы для гелия:
Атомный вес. А = 4,0033 ± 4 × 10 - 6
Удельная газовая постоянная R = 2077,27 ± 0,04 Дж/(кг K)
Температура кипения при нормальном давлении T к = 4,22 K
Критическая температура T кр = 5,19 K
Критическое давление P кр = 0,227 MПa
Таким образом, в порядке высот имеются слои с высокими концентрациями кислорода, гелия, а затем водорода, который является самым простым из газов. Азот и кислород представляют собой постоянные компоненты состава атмосферы. В настоящее время присутствие кислорода не подтверждено в атмосфере других планет. Кислород, а также углекислый газ являются газами, непосредственно участвующими в живых процессах, в то время как действие азота является косвенным, как замедлитель окислительных процессов. Самыми важными компонентами атмосферы являются водяной пар, диоксид углерода и озон, а также некоторые взвешенные частицы.
Критическая плотность r кр = 70,2 кг/м 3 3
Удельный объем
Для расчета удельного объема по уравнению состояния реального газа учитывается второй вириальный коэффициент, м 3 /кг :
V = 1/r = RT/P+B(T) (1 )
B(T) = α 1 T* 1/2 + α 2 T* 1/3 α 3 T* 1/4 ,(1а )
где T* = T/10 4 , T в K, α 1 = – 0,0436074;α 2 = 0,0591117; α 3 = – 0,0190460. Точность расчета B (T) составляет 2 % при температурах в диапазоне T = 300 - 1300 K, и - 5 %при температурах в диапазоне T = 1300 - 2500 K.
Удельная изобарная теплоемкость. Дж /(кг· K ) :
H p (T, P) = H po - [RT 2 (d 2 B/d T 2)] (P/RT), (2)
где H po = 5 R /2 = 5193,17 Дж/(кг·K ), температура T измеряется в K, давление P- в Пa . Точность аппроксимации опытных данных не хуже, чем 0,1 %.
Удельная изохорная теплоемкость, Дж /(кг·K ) :
H v ( T, P) = H vo - R (P/RT), (3)
где H vo = 3 R /2 = 3115,91 Дж/(кг К). Точность аппроксимации не превышает 0,1 %.
Показатель адиабаты (изоэнтропы )
Показатель изоэнтропы , приводится в соответствии с работой :
где в качестве предела при P ® 0 k ® 5/3.
Термодинамическая скорость звука, м /с, :
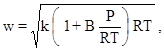 (5)
(5)
где давление P - в Пa , температура T измеряется в K.
Удельная энтальпия Дж /кг, :
![]() (6)
(6)
где D Э o = H p o T = 5193,17 T, Дж/кг. Точкой отсчета принято состояние идеального газа (0 K). Точность аппроксимации (при T = 300 - 2500 K и P в диапазоне от 0,1 до 6 Мпа) не превышает 0,1 %.
Удельная энтропия, Дж /(кг·K ), по данным работ :
![]() (7)
(7)
где
где температура T измеряется в K, давление P - в Пa , P o = 0,101325 10 6 Па. Точность при температуре в диапазоне T = 300 - 2500 K и при давлении в диапазоне P = 0,1 6 МПа не превышает 0,1 %.
Коэффициент динамической вязкости, Па с , приводится по работе :
![]() (8)
(8)
где
![]() (8a)
(8a)
![]() (8б)
(8б)
где T* = T/10 4 , T измеряется в K, P - в Па, β 1 = 0,46041; β 2 = – 0,56991; β 3 = 0,19591; β 4 = – 0,03879; β 5 = 0,00259. Точность при температуре в диапазоне T = 300 - 1200 K составляет 1,5 %и при температуре в диапазоне T = 1200 - 2500 K составляет 2,5 %.
Коэффициент теплопроводности, Вт / (м·K ), :
![]() (9)
(9)
Где
![]() (9a)
(9a)
K 1 показан выше, точность при температуре в диапазоне T = 300 - 1200 K составляет 1,5 % и при температуре T = 1200 - 2500 K составляет2,5 %.
Данные, приведенные в таблице ниже, рассчитаны по приведенным выше соотношениям. Кроме того, соотношение δ = β/ r используется для расчета коэффициента кинематической вязкости; γ = α/(H p r ) – для коэффициента температуропроводности , и ε = δ / γ– для числа Прандтля.
Мы исключили значения теплоемкости Н из приведенной ниже таблицы,т.к.в исследуемом интервале температур темплоемкость слабо изменяетсяи равна 5,193 Дж/(г· К).
Cтраница 1
Плотность гелия но отношению к воздуху составляет 0 138, удельный объем - 5 596 см3 / г. Гелий почти не растворим в воде и других жидкостях и меньше, чем любой другой газ склонен к адсорбции.
Плотность гелия при 0 и 1 атм равна.
Плотность гелия составляет примерно V. Поскольку шар находится в воздухе, простой путь решения задачи состоит в следующем: считать плотность шара равной - 6 / 7 рвозд и не обращать в дальнейшем внимания на присутствие воздуха.
Добровольским и Голубевым определена плотность гелия на восьми изотермах от 20 до 164 К и шести изобарах до 500 атм.
Из табл. 2 видно, что плотность гелия невелика, а теплоемкость значительна; по этим характеристикам гелий уступает только водороду. Газообразный гелий обладает высокой теплопроводностью и является хорошим теплоносителем.
Какова подъемная сила F 1 м3 гелия, идущего на наполнение дирижаблей, если плотность гелия относительно воздуха равна 0 137 и 1 м3 воздуха весит 1 3 кгс.
F - численный коэффициент для приведения удельного веса ртути к значению, соответствующему стандартному значению ускорения силы тяжести и температуре 0 С; - 0 001 - суммарная поправка на капиллярную депрессию уровня ртути (диаметр трубки барометра 32 мм); / j - расстояние в мм от средней точки спирали термометра до линии конденсации водяного пара (направление вверх считается положительным); / 2 - расстояние в мм от линии конденсации водяного пара до нижнего мениска ртути в барометре (направление вверх считается положительным); гг - отношение плотности насыщенного водяного пара при давлении р к плотности ртути; г2 - отношение плотности гелия при давлении р и комнатной температуре к плотности ртути.
Отделенный, как аргон, от азота и других подмесей, гелий выделяется из смеси с другими аргоновыми газами на основании того, что он легче их всех, а потому проникает чрез пористые перегородки в наибольшем количестве, а при действии холода, даже развиваемого жидким водородом, не превращается в жидкое состояние ; если же гелий смешан с другими аргоновыми газами, то при их сжижении растворяется в них, а такой раствор при - 250 (жидкий водород) выделяет в пустоту почти один гелий. Плотность гелия лишь в 2 0 раза превосходит плотность водорода, так что после него это наиболее легкий газ. В части аргоновых газов, подверженных сжижению, и в тех частях сжиженного воздуха, которые испаряются наиболее трудно, находятся еще два газа, считаемые, как аргон, простыми телами, но кипящие выше аргона, а именно криптон Кг 81 8 и ксенон Хе 128, открытые Рамзаем и Траверсом.
Рассмотрим теперь взаимодействие нейтрона с ротонным спектром. Нам необходимо определить изменение плотности гелия в месте нахождения нейтрона, обусловленное наличием ротонов.
В заключение мы должны рассмотреть переходы из состояния квазисвободной плоской волны в локализованное состояние электрона в гелии. Сандерс и Левин наблюдали , что, когда плотность гелия в газовой фазе возрастает при 4 2 К, в области 6 - Ю20 - 1 2 - 1021 атом / см3 достигается критическое значение плотности, начиная с которого подвижность электрона убывает на три-четыре порядка до величины, соответствующей подвижности электрона в жидкости. Теоретическое исследование зависимости энергий свободного и локализованного состояний электрона от плотности в гелии приводит к значению 1 0 - 1021 атом / смА, выше которого локализованные состояния становятся более стабильными, чем свободные. Это теоретическое значение хорошо согласуется с экспериментальными данными. Полученный результат легко понять, если учесть, что при относительно низких плотностях пузырек не является конфигурацией с наинизшей энергией, поскольку работа объемного расширения, требующаяся для образования полости, еще велика. В то же время снижение энергии локализованного состояния по сравнению с энергией плоской волны мало ввиду малой плотности. Эксперименты Сандерса вместе с изложенными соображениями подтверждают применимость пузырьковой модели.
В заключение мы должны рассмотреть переходы из состояния квазисвободной плоской волны в локализованное состояние электрона в гелии. Сандерс и Левин наблюдали , что, когда плотность гелия в газовой фазе возрастает при 4 2 К, в области б - Ю20 - 1 2 - 1021 атом / см3 достигается критическое значение плотности, начиная с которого подвижность электрона убывает на три-четыре порядка до величины, соответствующей подвижности электрона в жидкости. Теоретическое исследование зависимости энергий свободного и локализованного состояний электрона от плотности в гелии приводит к значению 1 0 - 1021 атом / см3, выше которого локализованные состояния становятся более стабильными, чем свободные. Это теоретическое значение хорошо согласуется с экспериментальными данными. Полученный результат легко понять, если учесть, что при относительно низких плотностях пузырек не является конфигурацией с наинизшей энергией, поскольку работа объемного расширения, требующаяся для образования полости, еще велика. В то же время снижение энергии локализованного состояния по сравнению с энергией плоской волны мало ввиду малой плотности. Эксперименты Сандерса вместе с изложенными соображениями подтверждают применимость пузырьковой модели.
Процесс при небольших перепадах протекает почти обратимо в. Др устанавливается разность темп-р ДГ такая, что Др р5ДГ, где р - плотность гелия, S - энтропия единицы массы гелия.
Вычислить вероятность рассеяния удается только для нейтронов, скорость которых меньше скорости звука в гелии II, что соответствует энергиям, меньшим, чем 3 5 К. В этом случае энергия взаимодействия нейтрона с гелием имеет весьма простой вид - она пропорциональна плотности гелия. В промежуточной области энергий, между 3 5 и 15 5 К, вычисления наталкиваются на большие затруднения.
Активированные угли были получены прокаливанием сарана при 600 с последующей обработкой паром при 950; длительность обработки паром последовательно увеличивалась. В третьем и четвертом столбцах даны объемы, вычисленные по правилу Гурвича по изотермам адсорбции NJ и СгН5С1; в пятом столбце приведены объемы, вычисленные по плотности гелия и ртути.




